中國科大工程科學學院近代力學系姜洪源教授團隊揭示了不同形式和不同程度的受限力學環(huán)境對細胞多極紡錘體的調控機制���,近日�,相關研究成果以“Appropriate Mechanical Confinement Inhibits Multipolar Cell Division via Pole-Cortex Interaction”為題�,做為Featured in Physics論文在線發(fā)表于《Physical Review X》雜志。
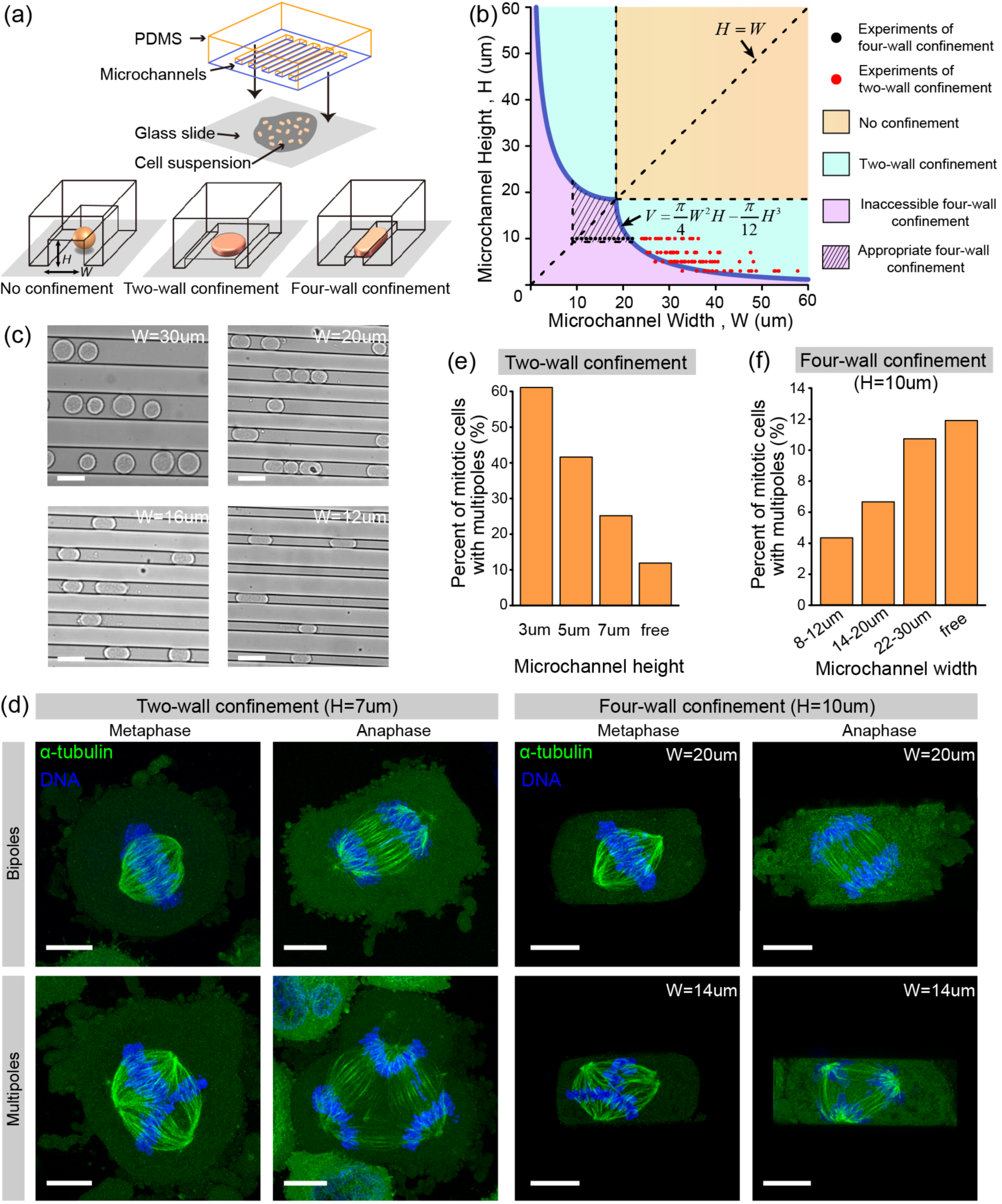
圖1:兩面受限內多極紡錘體出現的概率很高,而四面受限內多極紡錘體出現的概率較低����。(a)實驗裝置圖。(b)劃分自由不受限����、兩面受限、四面受限的相圖��。(c)不同寬度的四面受限內細胞的顯微鏡明場圖���。比例尺為30微米�。(d)兩面受限和四面受限內細胞形成雙極或多極紡錘體結構�����,并且完成細胞分裂��。比例尺為10微米�。(e)兩面受限內多極紡錘體的統計比例��。(f)四面受限內多極紡錘體的統計比例����。
多極紡錘體和多極細胞分裂普遍存在于癌細胞中����,其被認為與細胞的癌變和腫瘤的惡化密切相關��。目前關于多極紡錘體的研究大多基于簡單的體外二維培養(yǎng)體系�����,但是復雜的體內環(huán)境如何影響多極紡錘體還知之甚少�����。事實上�����,體內環(huán)境是空間受限的力學微環(huán)境�,細胞會受到周圍其它細胞和細胞外基質的空間約束,因而其形狀���、粘附��、遷移�����、有絲分裂以及染色體分離都與體外培養(yǎng)環(huán)境截然不同����。

圖2:(a)細胞五極紡錘體(四面受限)的三維重構圖。(b)自由不受限���、兩面受限�����、四面受限內的細胞發(fā)生劈裂��、維持�����、合并等行為。
在乳腺�����、胚胎上皮組織和新生肝臟組織內���,上皮細胞的染色體分離幾無差錯�;但是,當這些上皮細胞從其天然組織中解離并在體外環(huán)境下進行二維培養(yǎng)時�,染色體分離的錯誤率顯著上升。這表明正常的組織結構為細胞提供的受限力學環(huán)境可以限制多極紡錘體的發(fā)生���。
然而與正常組織相比�����,許多腫瘤組織中的多極紡錘體出現概率要高得多�,這可能是由于癌細胞所處的極度擁擠的三維微環(huán)境所導致的���。在腫瘤生長過程中���,體內癌細胞不受控制地增殖,這將在腫瘤內部產生擠壓應力��,這些應力的累積將使癌細胞受到嚴重的擠壓��,甚至導致腫瘤內部的血管和淋巴管坍塌閉合�。正常組織和腫瘤組織之間的顯著差異表明:細胞對其所處的受限力學微環(huán)境非常敏感。然而���,正常組織和腫瘤組織所提供的受限力學微環(huán)境之間的區(qū)別�,以及它們如何影響多極紡錘體和染色體分離還有待研究。
針對這一科學問題�����,姜洪源教授課題組使用微納加工技術制作了具有不同高度和寬度的微通道����,用來模擬組織結構中不同形式和不同程度的機械約束,研究了不同形式和不同程度的受限力學環(huán)境對細胞多極紡錘體形成的影響��,并進一步闡明了其內在機理����。該研究發(fā)現隨兩面約束程度的升高(兩面間距變小)�,多極紡錘體出現概率從12%增加到60%;而隨著四面約束程度的升高(管道高度不變�����,寬度降低)���,多極紡錘體出現概率則從12%降低到4%�。進一步的實驗證實了兩面受限環(huán)境通過紡錘極的分裂導致多極紡錘體比例的增加�����,而四面受限環(huán)境則通過增強紡錘極的聚合和抑制紡錘極的分裂來抑制紡錘體的多極性��。結合實驗�����、數值模擬和理論模型���,姜洪源教授課題組進一步將紡錘體極的分裂和聚合視為可逆的化學反應��,并證明四面受限力學微環(huán)境能夠控制細胞的形狀�,進而調節(jié)細胞皮層和紡錘體極之間的相互作用��,從而改變紡錘體極的分裂和聚合的能量勢壘以及多極紡錘體出現的概率�。該項研究成果揭示了不同形式的受限力學微環(huán)境對細胞分裂和紡錘體構型的調控機制,為細胞力學微環(huán)境調控細胞內生理活動提供了有力證據�,同時對發(fā)展靶向腫瘤微環(huán)境的癌癥療法也具有重要意義。
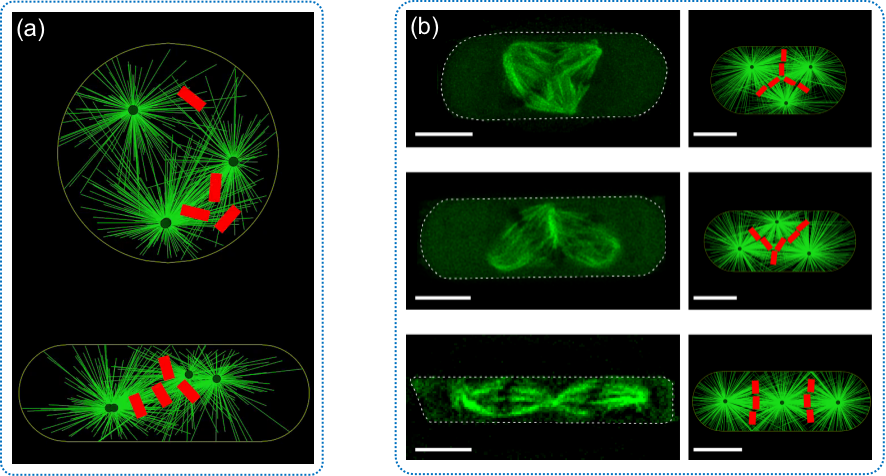
圖3:四面受限的力學環(huán)境改變細胞形狀�����,進而調控紡錘體的劈裂與合并行為。(a)計算模擬四面受限的力學環(huán)境調控紡錘體的劈裂與合并行為���。(b)不同受限程度的三極紡錘體構型的實驗結果(左)和計算模擬(右)對比���。比例尺為10微米。
著名科普作家Philip Ball在Physics Focus專欄以《Four Walls Good, Two Walls Bad for Confined Cells》為題重點推薦了該研究工作(詳情請參閱https://physics.aps.org/articles/v16/38 )��。同時�,該研究工作也得到了同行專家的高度評價。紐約大學的計算生物學家Alex Mogilner稱贊“他們解決的問題對生物醫(yī)學應用非常重要�,因為許多癌癥細胞,甚至健康細胞�,都會組裝多極紡錘并錯誤分裂”(“The problem they addressed is very important for biomedical applications, as many cancer cells, and even healthy cells, assemble multipolar spindles and divide incorrectly” )。耶魯大學的生物物理學家Jonathan Howard則表示“該項研究應該是第一次直接證明細胞形狀是多么重要的研究���,也是利用自下而上的物理學方法解決復雜生物學問題的一個非常好的案例”(“This is pretty muchthe first studythat directly demonstrates how crucial the cell shape is. It is a great example of a bottom-up physical approach to a complex biological problem.”)�,“ 填補了關于多極紡錘體的知識空白”(“highlight how little we know about spindle multipolarity”)���。
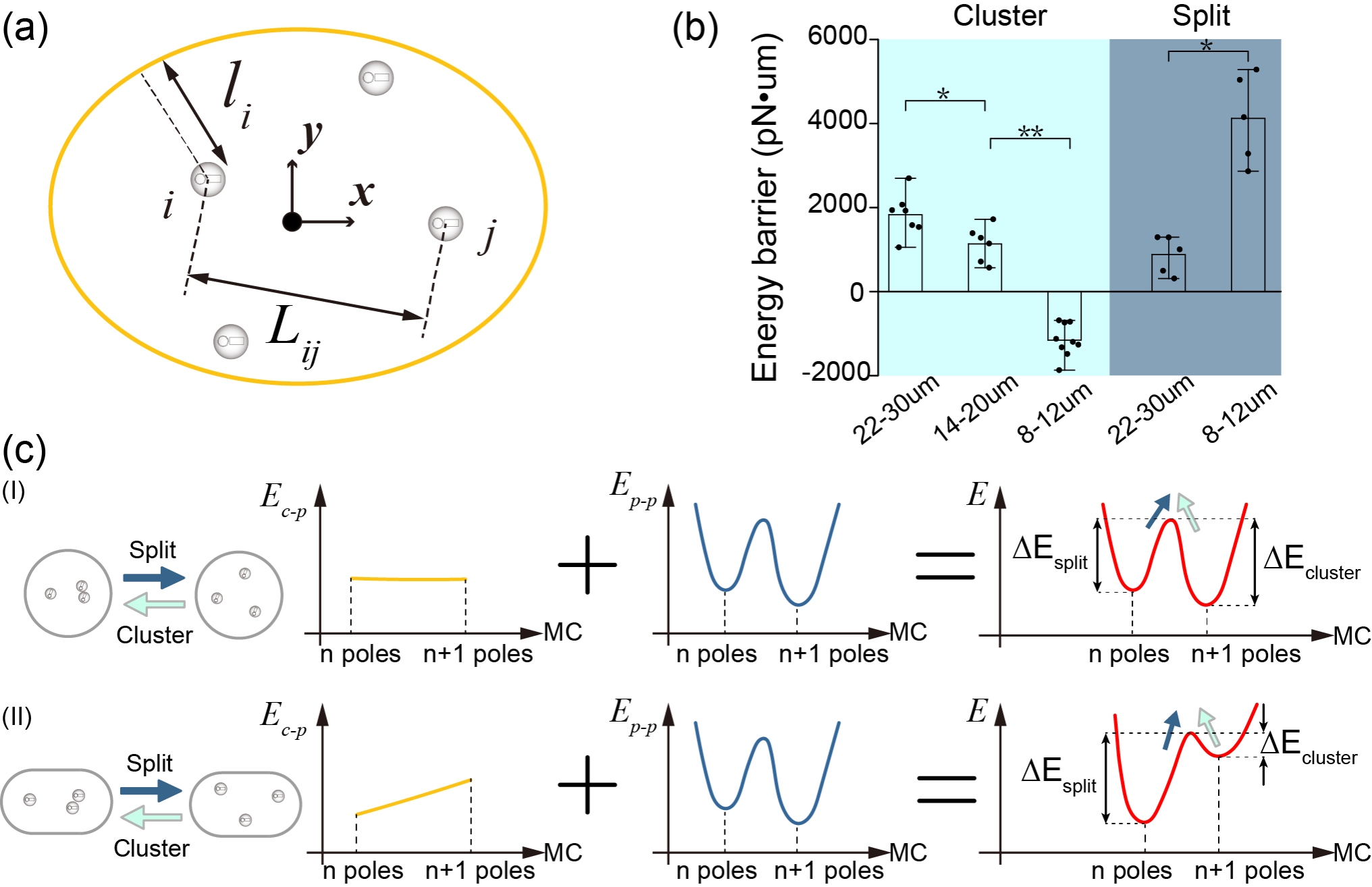
圖4:理論模型揭示細胞形狀調控紡錘體的劈裂與合并行為����。(a)理論模型示意圖。(b)計算并統計實驗中的紡錘體劈裂與合并行為的能量勢壘��。(c)四面受限的力學環(huán)境調控紡錘體行為的機理��。較寬的管道內細胞呈圓形�����,極與細胞皮層的距離較遠���,因此極與極之間的相互作用并不顯著(I)。而較窄的管道內細胞呈細長形�,極與皮層的平均距離較近,因而使得極與極之間的相互作用變得顯著�,進而增大紡錘極劈裂的能量勢壘,同時也減小紡錘體合并的能量勢壘(II)���。
中國科大工程科學學院博士生程龍燦為該論文的第一作者����,李景辰博士為論文的共同第一作者�,博士生孫厚波為共同作者,姜洪源教授為通訊作者�����。該項研究得到了國家自然科學基金、微尺度國家研究中心�、中科院材料力學和行為設計重點實驗室、中國科學技術大學微納研究與制造中心的支持����。
論文鏈接:https://journals.aps.org/prx/abstract/10.1103/PhysRevX.13.011036
(近代力學系、科研部)

